認知症のリスク因子
認知症にならないためにできること
認知症にならないためにできることがあります。
殆どの病気に共通のことですが、認知症になるには、遺伝的要因と後天的な要因とがあります。
認知症になりやすい遺伝子を持っていると、認知症になりやすいと言えます。
しかしながら、そのリスクをできるだけ低くすることは可能です。
下の図は、世界の超一流医学誌であるLANCETに2020年に掲載された論文で示された図です。
認知症のリスク因子を年代別に列挙しています。
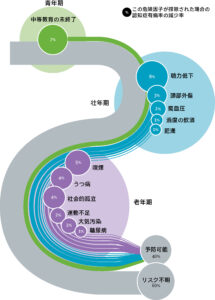
出典:Livingston. G, et al. Lancet 296, 413-445, 2020
認知症予防のための12項目
世界保健機構(WHO)は、2019年に「認知機能低下および認知症のリスク低減(Risk reduction of cognitive decline and dementia )」を発表しています。

こちらで示された認知症予防のために考えられることとして、以下の12項目についてそのエビデンスレベル(根拠の強さ)を示しています。
1 身体活動による介入
身体活動(つまり運動)は、認知症予防のために最も重要な事項の1つと考えられています。
身体活動を有する群は有さない群に比べ認知機能低下・認知症・血管性認知症・アルツハイマー病などの発症リスクが低いと報告されています(Gallaway et al., 2017; Hamer & Chida, 2009; Sofi et al., 2011; Stephen et al., 2017)。
特に、最も活動的な身体運動は予防効果も最も高いようです。
身体活動は、認知機能正常の成人に対して認知機能低下のリスクを低減するために推奨される。
エビデンスの質: 中
推奨の強さ: 強い
推奨2:
身体活動は、軽度認知障害の成人に対して認知機能低下のリスクを低減するために推奨してもよい。
エビデンスの質: 低い
推奨の強さ: 条件による
65 歳以上の成人にとって、身体活動とは、日課や家庭・地域社会と結びついたレクリエーションや余暇を使って身体を動かすこと。
通勤などの移動(徒歩、自転車)、仕事、家事、遊び、ゲーム、スポーツなどを含む。
持久力、 筋力、骨の健康向上や、非感染性疾患の発症、うつ病、認知機能低下のリスク低減のために、下記の項目が推奨さ れる。
1. 65 歳以上の成人は、週あたり150 分の中強度有酸素運動、週あたり75 分の高強度有酸素運動、または、同等の中~高強度の運動を組み合わせた身体活動を行うこと
2. 有酸素運動は 1 回につき、少なくとも10 分以上続けること
3. さらなる健康効果のため、中強度有酸素運動を週300 分に増やすこと。または週150 分の身体活動を高強度の有酸素運動にすること。または、同等の中~高強度の身体活動を組み合わせて行うこと
4. この年齢群に属する高齢者で運動制限を設ける場合には、バランス能力を向上させ転倒を防ぐための身体活動を週3 日以上行うこと
5. 筋力トレーニングは週2 回以上、主要な筋肉群を使うトレーニングをすること
6. 健康状態によって、高齢者がこれらの推奨する身体活動を実施できない場合は、身体能力や健康状態の許容範囲で可能な限り活動的でいること
以上、すべての年齢群において、上記に推奨する身体活動を実施することや、活動的でいることでの健康上の利益は、身体活動で引き起こされる有害事象や危険性を上回る。
推奨される週150 分の中強度の身体活動において、骨格筋の損傷や怪我はまれである。
集団ベースのアプローチ方法では、骨格筋の怪我を低減させるために、適度な身体活動から徐々に量・強度とも増やしていくことが適切であると考えられる。
筋力トレーニングよりも有酸素トレーニングの方が効果の程度は大きく、認知機能正常の人の方が軽度認知障害の人よりも効果が強い(とくに有酸素トレーニング)、ということを示すエビデンスがある。
2 禁煙介入
タバコ依存症は、認知症や認知機能低下と関係する(Durazzo et al)だけでなく、他の障害や高齢者のフレイル(虚弱)や作業能力など加齢に伴う状態にも関連しています(Amorim et al., 2014; Kojima et al., 2015)。
推奨:
禁煙介入は、他の健康上の利点に加えて、認知機能低下と認知症のリスクを低減する可能性があるため、喫煙者 している成人に対して行われるべきである。
エビデンスの質: 低い
推奨の強さ: 強い
喫煙が認知機能障害と認知症の危険因子であることを示す多くの観察研究によるエビデンスが報告されている。これらの研究は、喫煙(中年期を含む)と認知症、または老年期の認知機能低下との関連を示している(Beydoun et al., 2014; Di Marco et al., 2014;Lafortune et al., 2016; North et al., 2015; Xu et al., 2015; Zhong et al., 2015)。
3 栄養的介入
食事の変化が、糖尿病や脳血管疾患のような認知症リスクを高める多くの病的状態の予防に関わっていることが実証されています(DiabetesPrevention Program Research Group, 2002; Tuomilehto et al., 2001; Rees et al., 2013)。
認知症の発症には、食事要因が直接的なものと他の危険因子に対する役割を介したものの両者が関与しており、健康的な食事が認知障害を予防する可能性は大きいようです。
個々の食品と栄養素については、果物と野菜(Jianget al., 2017; Wu et al., 2017) と魚類(Bakre et al., 2018; Zhang et al., 2016)の摂取と認知症リスクの低下との関連性は最も一貫性が高いとされます。
多くの研究において、魚を多く摂るほど、健康な参加者の記憶力低下が抑えられています(Samieri et al., 2018)。
多価不飽和脂肪(魚由来)の摂取(Zhang et al., 2016)も同様に有効です。
認知症や認知機能障害のリスクの低下に関連づけられている他の食品と栄養素としては、ナッツ、オリーブオイル、コーヒーがあります(Solfrizzi et al., 2017)。
推奨1:
地中海食は、認知機能正常または軽度認知障害の成人に対して認知機能低下や認知症のリスクを低減するために 推奨してもよい。
エビデンスの質: 中
推奨の強さ: 条件による
推奨2:
WHO の健康食に関する推奨に準拠して、健康なバランスのとれた食事は全ての成人に対して推奨される。
エビデンスの質: 低い~高い(食事の成分による)
推奨の強さ: 強い
推奨3:
認知機能低下や認知症のリスクを軽減するため、ビタミンB、E、多価不飽和脂肪、複合サプリメントは推奨されない。
エビデンスの質: 中
推奨の強さ: 強い
観察研究による幾つかのシステマティックレビューでは、地中海食を順守すると、軽度認知障害やアルツハイマー病のリスクを低下させたが、そうでない場合は低下させなかったと結論づけている(Singh et al., 2014; Wu&Sun, 2017)。
さらに、認知機能正常者においては、地中海食の順守は良好なエピソード記憶や全般的認知機能と関連していた(Loughrey et al., 2017)。
良好な認知機能と関連する他の有望な食事アプローチには、高血圧を防ぐ食事(DASH)(Berendsen et al., 2017; Morris et al., 2015a; 2015b; Wengreen et al., 2013)や神経変性抑制のための脳の健康に特化した地中海食-DASH 食(MIND) がある。
個々の食品と栄養素については、果物と野菜(Jiang et al., 2017; Wu et al., 2017) と魚類(Bakre et al., 2018; Zhang et al., 2016)の摂取と認知症リスクの低下との関連性は最も一貫性が高い。
多くの研究において、魚を多く摂るほど、健康な参加者の記憶力低下が抑えられている(Samieri et al., 2018)。多価不飽和脂肪(魚由来)の摂取(Zhang et al., 2016)も同様である。
認知症や認知機能障害のリスクの低下に関連づけられている他の食品と栄養素としては、ナッツ、オリーブオイル、コーヒーがある(Solfrizzi et al., 2017)。
葉酸、ビタミンE、カロチン、ビタミンC、ビタミンD に関するエビデンスも報告されているが(Balion et al., 2012;Dangour et al., 2010; Rafnsson et al., 2013; Travica et al., 2017)、結果は一貫していない。
健康的な食事の内容:
• 果物、野菜、豆類(レンズ豆、豆など)、ナッツ、全粒穀物(未加工のトウモロコシ、キビ、オート麦、小麦、玄米など)
• 1 日あたり最低400 g(5人前)の果物と野菜。ジャガイモ、サツマイモ、キャッサバ、その他のでんぷん質 の根菜は果物や野菜に分類されない。
• 1 日あたり約2,000 キロカロリーを摂取する健康体重の人の場合、総エネルギー摂取量のうち遊離糖類(ブドウ糖・果糖・しょ糖・食卓砂糖など)からの摂取量は10%未満であること(50g または小さじ約12 杯に相当)。しかし、理想的には総エネルギー摂取量 の5%未満とすると、さらに健康上の利益が得られる。ほとんどの遊離糖類は製造業者や料理人や摂取者が食 品や飲料に添加し、また蜂蜜、シロップ、果汁、濃縮果汁に天然の糖として含まれている。
• 総エネルギー摂取量のうち、脂肪からのエネルギー摂取量は30%未満であること。不飽和脂肪酸は、飽和脂肪酸やあらゆる種類のトランス脂肪酸よりも好ましい。飽和脂肪酸の摂取量を総 エネルギー摂取量の10%未満に、トランス脂肪酸を総エネルギー摂取量の1%未満に抑えることが推奨される。 特に、工業的に生産されたトランス脂肪酸は健康食の成分にはならないので、避ける必要がある。
不飽和脂肪酸:魚、アボカド、 ナッツ、ヒマワリ、キャノーラ、オリーブオイルに含まれている
飽和脂肪酸:脂肪の多い肉、バター、 ヤシ、ココナッツオイル、クリーム、チーズ、ギー、ラードに含まれている
トランス脂肪酸:加工食品、ファストフード、スナック食品、揚げ物、冷凍ピザ、パイ、クッキー、ビスケット、ウエハース、 マーガリン、スプレッドに含まれる工業的に生産されたトランス脂肪酸や、肉・乳製品に含まれる牛、羊、山羊、 ラクダのような反芻動物由来のトランス脂肪酸の両方が含まれる
• 食塩は1日あたり5g(小さじ約1 杯に相当)未満であること。ヨウ素添加塩を用いること。
4 アルコール使用障害への介入
過剰なアルコールは認知症および認知機能低下の危険因子として多くの証拠が報告されています(Langballe et al., 2015; Sachdeva et al., 2016; Zhou et al., 2014)。
推奨:
危険で有害な飲酒を減量または中断することを目的とした介入は、他の健康上の利点に加えて、認知機能正常または 軽度認知障害の成人に対して認知機能低下や認知症のリスクを低減するために行われるべきである。
エビデンスの質: 中(観察研究によるエビデンス)
推奨の強さ: 条件による
5 認知的介入
複数の研究において、認知活動の増加が認知予備能を刺激し(もしくは増加させ)、急速な認知機能低下をやわらげる効果を有することが報告されています( Stern& Munn, 2010)。
同様に、認知活動レベルが高い者は低い者と比較し、軽度認知障害またはアルツハイマー病診断のリスクが有意に低下する可能性が示されています(OR=0.38, 95%CI:0.15–0.99)(Sattler, 2012)。
推奨:
認知トレーニングは、認知機能正常または軽度認知障害の高齢者に対して認知機能低下や認知症のリスクを低減 するために行ってもよい。
エビデンスの質: 非常に低い~低い
推奨の強さ: 条件による
認知活動は、認知刺激や認知トレーニングによって増加させることができる。
認知刺激とは、「認知機能および社会機能の改善を目的とした様々な活動への参加」のことを指し(Clar e& Woods, 2004)、認知トレーニングとは、「特定の認知機能を高めるために定められた個々の標準化された課題を指針に沿って実践すること」を指す(Clar e & Woods, 2004)。
WHOの ICOPEガイドライン(http://www.who.int/ageing/publications/guidelines-icope/en/)では、認知機能障害のある高齢者に対して認知刺激を行うことを推奨している。
6 社会活動
社会的関わりが失われることは、高齢者において認知機能障害や認知症のリスクを高めるということが示されました(Fratiglioni et al., 2004)。
縦断的 コホート研究のシステマティックレビューやメタ分析によると、社会参加が少ないこと、社会交流が少ないこと、孤独であることなどは認知症の発症率を高めるとされています(Kuiper etal., 2015)。
さらにランセット委員会の認知症予防・介入・ケア委員会は社会的関わりを認知症予防を目的とした介入手法になりえるとしています(Livingston et al., 2017)。
推奨:
認知トレーニングは、認知機能正常または軽度認知障害の高齢者に対して認知機能低下や認知症のリスクを低減 するために行ってもよい。
エビデンスの質: 非常に低い~低い
推奨の強さ: 条件による
7 体重の管理
最近のシステマティックレビューと計約60 万人を対象とした観察研究のメタ分析により、中年期の肥満(ただし過体重ではない)が認知症のリスクを高めることが示されました(RR=1.33; 95% CI:1.08‒1.63)(Albanese et al., 2017)。
体重を減らすことは、認知機能障害および認知症の病因に関連する様々な代謝因子(すなわち、耐糖能、インスリン感受性、血圧、酸化ストレス、および炎症反応)の改善を通じて認知症の発症リスクを減らすことができると示唆されています(Bennett et al., 2009)。
一方、減量への介入に直接的な有効性があることも十分に考えられます。
これまでのところ、認知機能に対する体重減少の潜在的効果は身体活動の増加と強く関連しているようにみえます(Colcombe et al., 2006; Erickson et al., 2010)が、2011 年のシステマティックレビューでは、体重の減少を意識的に行うことで、少なくとも肥満者の一部の認知機能領域が改善できると結論づけています(Siervo et al., 2011)。
推奨:
中年期の過体重、または肥満に対する介入は、認知機能低下や認知症のリスクを低減するために行ってもよい。
エビデンスの質: 低い~中
推奨の強さ: 条件による
(Lee CM, et al. Obesity Reviews. 2020;21:e12989)
観察研究から得られた過体重や肥満と、認知症の発症リスク上昇との関係は、老年期よりも中年期でより強く一貫していた(Hersi et al., 2017; Lafortune et al., 2016; Pedditzi et al., 2016; Prickett et al., 2015; Xu et al., 2015)ため、GDG は条件付きで推奨。
8 高血圧の管理
中年期の高血圧は、老年期認知症の発症リスク増加と関連することが示されています(Kivipelto et al., 2001)。
特に、中年期に血圧が上昇し、その後急速に低下するパターンが認知症発症者に見られるようです(Kivipelto et al., 2001; Launer et al., 2000; Stewart et al., 2009)。
推奨1:
高血圧の管理は、現行のWHO ガイドラインの基準に従って高血圧のある成人に対して行われるべきである。
エビデンスの質: 低い~高い(介入方法によって)
推奨の強さ: 強い
推奨2:
高血圧の管理は、高血圧のある成人に対して認知機能低下や認知症のリスクを低減するために行ってもよい。
エビデンスの質: 非常に低い(認知症との関連について)
推奨の強さ: 条件による
高血圧治療が認知機能低下と認知症の発症リスク低減に有効かどうかについて一定した見解はない。
収縮期血圧介入試験〔SPRINT〕のサブスタディである認知症の発症リスクに対する集中的な血圧管理の効果を検討したSPRINT-MIND トライアルの初期の結果では、血圧と認知機能低下、認知症発症のリスク上昇との間に量反応関係がある可能性が示された(SPRINTMIND 2019)。
GDG は、高血圧治療が認知機能低下、または認知症の発症リスクを低下させるという臨床介入研究のエビデンスは限られているものの、それにより生活の質、または生活機能レベルを低下させることはないこと、および使用した薬剤による有害事象の可能性に関してもその結果が様々であることから、高血圧治療がもたらす利益は有害事象に勝ると結論づけている。
9 糖尿病の管理
高齢期の糖尿病は認知症リスクの上昇と関連しています(Luchsinger, 2010; Prince et al., 2014; Profenno et al., 2010)。
しかしながら、その発症機序は不明です。
不良な血糖管理は認知機能の低下や悪化と関連しています(Yaffe et al., 2012)。
さらに、腎症(腎臓障害)、網膜症(眼障害)、聴覚障害、心血管疾患のような糖尿病に伴う合併症はすべて、認知症リスクを上昇させることがわかっています(Bruce et al., 2014; Exalto et al., 2013)。
推奨1:
糖尿病のある成人に対して、内服やライフスタイルの是正、または両者による糖尿病の管理は現行のWHO のガ イドラインの基準に従って行われるべきである。
エビデンスの質: 非常に低い~中(各種介入による)
推奨の強さ: 強い
推奨2:
糖尿病の管理は、糖尿病患者に対して認知機能低下や認知症のリスクを低減するために行ってもよい。
エビデンスの質: 非常に低い
推奨の強さ: 条件による
10 脂質異常症の管理
大規模観察研究において、脂質異常症が認知症または認知機能低下のリスク上昇と関連しており、脂質異常症を管理することで認知症発症および認知機能低下のリスクが低減すると報告しています (Geifman et al., 2017; Hersi et al., 2017; Reitz, 2013; Song et al., 2013)。
中年期の脂質異常症の管理が認知機能低下や認知症の発症リスクを低減することを示唆する間接的なエビデンスが得られています。
推奨:
脂質異常症の管理は、脂質異常症のある中年期の成人において認知機能低下と認知症のリスクを低減するために 行ってもよい。
エビデンスの質: 低い
推奨の強さ: 条件による
観察研究では、老年期よりもむしろ中年期の高コレステロール血症と認知症発症の間に密接な関連があることを報告している(Hersi et al., 2017; Reitz, 2013)。
高齢者(65 歳以上)の臨床試験に焦点を当てたシステマティックレビューによると、スタチン治療は認知機能低下または認知症発症に影響を及ぼさないことが明らかになった(McGuinness et al., 2016)。
したがってGDG は、老年期におけるスタチン(代表的なコレステロール治療薬)の使用とコレステロールの管理を推奨する根拠はなく、中年期においてのみ推奨できると結論づけた。
11 うつ病への対応
うつ病は、認知所の発症リスクを高めるようです。
2014 年にWorld Alzheimer Report の一環で行われた文献レビューでは、32 の研究成果を対象として、認知症の発症率についてのうつ病の影響について、メタ分析が行われました。
62,568 名の患者が対象で、観察期間は平均5 年(2-17 年)で、うつ病の存在は認知症のリスクをほぼ2 倍にする(統合効果量=1.97, 95% 信頼区間1.67-2.32)という結果でした(Prince et al., 2014)。
経時的なメタ回帰分析も行われ、長期経過で効果が小さくなる傾向が認められ、うつ病は認知症の病前状態となっている可能性があることが示唆されています。
一方、GDG は現時点では、うつ病治療を行うことと認知機能低下または認知症のリスクを減らすこととについて、十分なエビデンスはまだないと結論づけています。
成人に対する抗うつ薬や心理療法を用いるうつ病治療は、現行のWHO mhGAP ガイドラインの基準に従って行 われるべきである。
12 難聴の管理
難聴は、認知機能低下または認知症のリスク増加と関連しています(Lin et al、2013)。
前向きコホート研究の最近のメタ分析は、アルツハイマー病とMCI の聴力障害の相対リスクが2.82 であることを示しています(95% CI:1.47–5.42)(Zheng et al.、2017)。
さらに、ランセット委員会が発表したメタ分析では、難聴があると認知症のリスクが約2 倍になることが示されました(RR = 1.94、95% CI:1.38–2.73)(Livingston et al、2017)。
一方、GDG は、現在、認知機能低下や認知症のリスクを減らすために補聴器の使用を推奨するには十分なエビデンスがないと結論付けています。
WHO ICOPE ガイドラインで推奨されているように、難聴を適時に発見し治療するために、スクリーニングと難聴のある高齢者への補聴器の提供が行われるべきである。



