神経膠腫(grade 2~4)-症状・診断-
神経膠腫とは
神経膠腫は、脳の神経膠細胞(グリア)と呼ばれる細胞から発生する腫瘍です。英語ではグリオーマ(glioma)と呼びます。
脳は、主に思考や感情に関わる神経細胞(ニューロン)と、神経細胞の活動を支えている神経膠細胞(グリア)から成ります。
神経膠腫の分類について
悪性度による分類
神経膠腫はgrade 1~4に分けられます。grade が高い方が悪性度が高く、grade 4は最も悪性度の高い腫瘍になります。
grade 1の星細胞系の腫瘍には、毛様細胞性星細胞腫、上衣下巨細胞性星細胞腫、脊索腫様膠腫などがあります(これらはgrade 2以上のものと性質が異なるため、ここでは割愛します)。
発生組織による分類
神経膠細胞には、星細胞(astroglia)、乏突起膠細胞(oligodendroglia)、小膠細胞(microglia)の3種が存在します。
星細胞が腫瘍化したもの:星細胞腫 IDH変異型 (grade 2:従来の「びまん性星細胞腫」)、grade 3:従来の「退形成性星細胞腫」、grade 4)
乏突起膠細胞が腫瘍化したもの:乏突起膠腫 IDH変異型,1p/19q共欠失(grade 2、grade 3)
最も悪性のもの:膠芽腫 IDH野生型 (grade 4)
その他、2021年の分類では
小児タイプのびまん性低悪性度グリオーマ
小児タイプのびまん性高悪性度グリオーマ
が分類され、それぞれ4種類あります。
乏突起膠腫については別項目でお話します。
遺伝子診断の進歩に従い、神経膠腫の分類は複雑化し、多様化しています。ここでは、従来の分類に従い、シンプルに説明しています。
頻度としては、grade 4が特に多く、原発性脳腫瘍の10%強を占めています。その他、grade 2とgrade 3は、それぞれ原発性脳腫瘍全体の3~4%程度を占めています。
分類と年齢
小児には少なく、grade 2は成人を中心に小児から高齢者まで幅広くみられます。Grade 4は高齢者(60歳以上)に多くみられます。
症状は?
神経膠腫は、脳のいろいろなところに発生します。発生した脳の部位により、症状は異なります。半身の麻痺や言語障害、部分的な視野障害などが代表的な症状です。
その他、脳の中でも特定の機能が出にくい部位に発生した腫瘍の場合、その症状は頭痛やけいれん発作(症候性てんかん)などになります。
Grade 2のものはゆっくり増大するため、頭蓋内圧亢進による頭痛は少なく、けいれんが多い傾向です。一方、grade 4のものは急速増大するため、頭蓋内圧が高まり、頻繁に頭痛を認めます。腫瘍が更に増大すると、意識障害に至り、死亡してしまいます。
診断は?
CTとMRI
診断には、脳のCTやMRIが有用です。


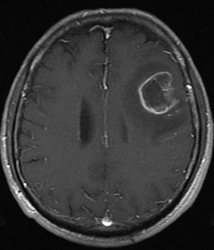
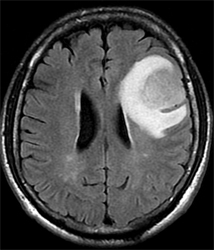
神経膠芽腫のMRI 造影画像とFLAIR画像
病院を受診した際に脳腫瘍が疑われると、造影剤を使用しない単純CTもしくは単純MRIを受けることになります。単純CTでは、脳の一部が不整な形で低吸収に(黒っぽく)映ります。単純MRIでも、それぞれの画像で正常の脳とは異なる色合いに見えます。
単純CTで脳腫瘍が疑われた場合、造影剤を使用したCTやMRIの追加検査を受けます。
造影剤が入っていく場合:grade 4もしくは3の疑い
造影剤が入って白く映る大きな塊がある場合:grade 4(神経膠芽腫)の疑い
腫瘍は、造影剤で白くなった部位の内部に黒い部分を含んでいることが多いのですが、これは腫瘍の活動が激しすぎて栄養不足で死んでしまった状態(壊死)を表しています。
なお、造影剤を使用しないMRI(T2強調画像やFLAIR画像など)では、造影剤で白く映るところの周辺にも正常とは異なる部位が広がっています。この部位は、腫瘍が正常脳の間に伸びて浸潤した部分になります。
その他、CTでは手術に必要な脳の血管の走行などに関する情報を得ます。MRIでは、血管系の情報に加え、脳機能に関わる情報の評価を行います。これには、functional MRI(機能的MRI)やMR tractography(MRトラクトラフィー)などを用います。
PET検査
神経膠腫の疑いがある場合には、CTやMRIのほかにPET検査も受けることになるかもしれません。PETには、保険適応のある糖代謝PET(fluorodeoxy glucose (FDG))をもちいたFDG-PETと、保険適応外の疎水性アミノ酸を用いたmethionine(メチオニン)-PETとがあります。両者とも、神経膠腫に対して有用な検査ですが、メチオニンの方が感度は優れているようです。
他の病変との判別
Grade 2が疑われる場合
Grade 2の神経膠腫と区別すべき病気として重要なのは、別の脳実質内腫瘍のほか、脳梗塞や、限局性皮質形成異常、変性疾患などです。
Grade 2の腫瘍で、腫瘍なのかそれ以外の病気なのか判断に迷う場合が時々あります。腫瘍の可能性が高ければ(腫瘍の存在部位にもよりますが)手術を受けることと思われます。一方、腫瘍以外の可能性が高いが、腫瘍である可能性も否定できない場合、診断を目的とした手術を行うのも選択肢ですし、まずは数か月後にMRIで再評価してもらい、増大傾向があれば手術を受ける方法もあります。
Grade 4が疑われる場合
Grade 4の神経膠芽腫と区別すべき病気として重要なのは、転移性脳腫瘍や悪性リンパ腫、脳膿瘍などです。神経膠芽腫のほか、悪性リンパ腫や脳膿瘍で、造影剤を使用した画像検査を行うと、腫瘍の中心部には造影剤が入らず(壊死)、その周りを取り囲むように造影剤が入っていくのが典型的な所見です(ring状増強と言います)。
転移性脳腫瘍の場合、癌になったことがあるかどうか、また腫瘍マーカー(血液検査)などで区別します。
悪性リンパ腫には、腫瘍マーカー(血液検査)も有用ですが、画像検査で造影剤が全体的に均一に入る感じがあり、神経膠芽腫とは異なります。
脳膿瘍とは、一瞬見間違うこともありますが、発熱を伴っている場合が多いですし、またMRIの拡散強調画像(diffusion-weighted image; DWI)という画像を撮ると一発で判ります。
病理組織診断(手術)
確定診断には、他の腫瘍と同様で、腫瘍の病理組織診断が必要です。
以前は、切除した腫瘍細胞の免疫染色を行い、顕微鏡による観察が診断の中心的な役割を果たしていましたが、最近は分子マーカーによる診断が重要視されています。
とりわけ、IDH遺伝子の変異が診断において極めて重要だと認識されています。膠芽腫(従来のデノボタイプ)と星細胞腫(従来のセカンダリータイプ)とではIDH1という遺伝子に違いがあり、後者ではIDH1遺伝子の変異があります。
また、p53蛋白を介するシグナル系変異と、それに関連のあるATRX遺伝子の変異は星細胞腫の特徴とされています。対照的に、乏突起膠腫の診断には1p/19q染色体の共欠失が重要です。
分子マーカーによる診断次第で、治療方法や今後の経過の見込みが異なるため、診断には必須なものとなっています。この診断方法はどこの病院でもできるわけではありません。こうした診断ができる病院で治療を受けるか、こうした診断ができる施設に診断を依頼してもらえるか、確認したほうがいいと言えます。



