心原性脳塞栓
心原性脳塞栓とは
心原性脳塞栓とは、心臓に血栓という血の塊ができて、それが心臓から飛んで脳血管を詰まらせたときに生じます。しばしばかなり大きな血管を閉塞して、大きな脳梗塞の原因となります。
症状は?
内頚動脈や中大脳動脈の本幹が閉塞すると突然の意識障害に至ります。
脳梗塞に陥った脳は徐々に腫れ上がってきます。数日後に脳のむくみ・腫れはピークに達し、周囲の健常な脳を強く圧迫するようになり、脳ヘルニアに至ってしまいます。脳ヘルニアが極まると死亡してしまいます。心原性脳梗塞の死亡率は12%にも達すると報告されています。
心原性塞栓による脳梗塞は、全てが巨大な脳梗塞ばかりとは限りません。小さな脳梗塞で済むこともあります。意識障害以外の症状として、脳梗塞の出来た部位により片麻痺、言語障害、視野障害、高次脳機能障害、ふらつき、嘔吐などがありえます。
意識障害がある場合、意識障害に加えて片麻痺などの上記神経症状を伴っていたら、脳卒中の可能性があります。
原因は?
では、心臓に何故血栓ができるのでしょうか。
最も多い原因は、心房細動という不整脈です。心臓が不規則に小刻みな動きをするので、心臓内部の血流が乱れて、血の塊を形成します。この血栓が血流に乗って脳血管に流れていくと、脳血管が詰まって脳梗塞が出来るのです。しかも、しばしば大きな血管が詰まってしまい、突然大きな脳梗塞が出来ることになります。
稀ですが、心臓以外にも塞栓源となる血栓が存在することがあります。心臓以外の塞栓源として比較的高頻度なものに、大動脈の粥状硬化巣や解離や下肢の静脈血栓などがありますす。心臓に明らかな塞栓源が見つからない場合にはこうした病変を疑う必要があります。
ただ、静脈の血栓は、静脈から剥がれて別のところに飛んで行っても通常は肺血管に流れていきます。肺塞栓も怖い病気ですが、脳梗塞にはなりません。脳梗塞になるためには、心臓の右心と左心との間、もしくは肺動脈と肺静脈の間に穴がなければなりません。心臓の穴としては卵円孔開存というものがあり、肺血管では肺動静脈瘻というものがあります。どうしても異常が見つからない場合にはこうしたことも考慮しなければなりません。
検査と診断は?
脳の画像診断
心原性塞栓ではしばしばとても大きな脳梗塞ができます。
脳梗塞の診断は、症状とCTやMRIによる画像検査によります。
MRIの拡散強調画像では、脳梗塞発症から1時間もすれば異常が出ている可能性があります(必ずしも異常が出ているとは限りません)。
MR血管撮影(MRA)では、閉塞した血管が消失している所見を確認することができます。
一方、CTでは、脳そのものの変化が明らかでなくても、脳梗塞の初期段階を表す微小な早期所見が見られることがあります。
①皮質・白質の境界の不鮮明化
②シルビウス裂や脳溝の狭小化
③基底核の不明瞭化
④中大脳動脈が高吸収に(白く)なる
などが挙げられます。
CTで脳の一部が黒くなっていたり、MRIのT2強調画像やFLAIR画像で白くなっていたりするのであれば、それは既に脳梗塞に陥り脳細胞が死んでしまった状態を表しています。脳梗塞発症から24時間程度(少なくとも6時間以上)経過してからみられる所見です。
心原性塞栓による脳梗塞が全て巨大な脳梗塞ばかりではありません。小さな脳梗塞で済むこともあります。
典型的な所見として、心原性塞栓では同時多発的に脳梗塞が出来ることも多いものです。左右の内頚動脈系や椎骨脳底動脈系のうちの二つ以上の血管系に同時に脳梗塞が出来た場合には心原性塞栓を疑うことになります。
塞栓源の検索
心原性塞栓の診断は、前述のような脳梗塞の分布や大きさのほか、塞栓の原因となりえる異常(塞栓源)の検索によります。
脳梗塞の患者さんは来院後直ちに心電図検査を受けて、不整脈がないかをチェックします。また、入院後にも必要に応じてベッド上で心電図検査を行います。外来患者さんでは、ホルター心電図という簡易型の心電図も有用です。
なお、心臓に異常がない場合には、前述のように下肢の静脈血栓などの可能性も考えなければなりません。
治療方法は?
脳梗塞発症後、早期にすること
① 血栓溶解療法(t-PA)
来院後間もない時点でCTの早期所見やMRI拡散強調画像で微妙な異常が出ていたら、血栓溶解療法(t-PA)が使える可能性があります。
発症から4.5時間以内であれば使えますが、早ければ早いほど効果が高い(つまり多くの脳組織を救うことができる)と言えます。
一方、CTやMRIで中大脳動脈領域の1/3を超えるような大きな脳梗塞が既に明らかな場合には、効果が落ちるばかりか、t-PA使用後に脳出血が起こる可能性が高いので、慎重にならなくてはなりません。
② 血栓回収療法
4.5時間以上経過して再開通が得られていない場合には、血栓回収療法(脳血管造影、脳アンギオによる方法)を行う場合があります。
対象血管は、内頚動脈、中大脳動脈、椎骨動脈、脳底動脈の閉塞です。適応としては、t-PAによる血栓溶解療法の適応外の患者や、t-PAの点滴後に血流再開が得られなかった患者さんで、脳梗塞発症から8時間(~最大24時間)以内に限られます。
実施できるのは、脳血管内治療専門医もしくは、それに準ずる経験を有する医師のみですから、施設は限られます。
③ 従来の治療
こうした治療の対象とならなかった患者さんに対しては、脳保護剤(エダラボン)の投与と、塞栓の再発予防のために抗凝固薬を用います。抗凝固薬としては、急性期には主にヘパリンという静脈注射薬が用いられます。その後はワーファリンや直接経口抗凝固薬(Direct Oral AntiCoagrants; DOAC)が経口薬として用いられます。
④ 外科治療
こうした治療が奏功せず、とても大きな脳梗塞が完成してしまった場合、脳がひどく腫れ上がり、脳ヘルニアの状態に落ちってしまう場合には、外科治療も考慮します。外科治療で出来ることは、頭蓋骨の一部を外すことです(減圧開頭と呼びます)。
減圧開頭は、脳梗塞に陥ってしまい、死んでしまった細胞を蘇らせるわけではありません。ただ、脳ヘルニアにより命を落としてしまうことを避けるだけの方法であり、つまり目的は救命です。
このような大きな脳梗塞ができてしまった場合には重篤な後遺症や高度の意識障害を残して寝たきりになってしまう可能性があります。特に、脳の優位半球(右利きの方の左脳)の場合にはその可能性がとても高いと言えます。従って、こうした手術を希望するかどうかについては、優位半球(左右の脳のうち、より重要な機能に関わる側の脳を指します)がどちらであるかも考慮に入れたうえで、主治医の話をよく聞いて検討すべきです。
予防のためにできること
心房細動のある患者さんでは、ワーファリンという薬を用いて血栓ができるのを予防します。この薬は、血液が凝固するために必要なプロトロンビンという物質の生成を阻害します。従って、血液が固まりにくくなるのです。最近では、前述の直接経口抗凝固薬(DOAC)も使われます。
心房細動にも、原因がいくつかあります。リウマチ性僧帽弁狭窄症および人工弁(機械弁および生体弁)置換術後のものを弁膜症性心房細動と呼び、それらを有さない非弁膜症性心房細動とを区別します。両者では塞栓症のリスクが異なります。
弁膜症性心房細動
僧房弁狭窄症では、僧帽弁が十分に開かなくなります。左心房の血液は、僧帽弁を通って左心室へ入ります。僧房弁が十分に開かなくなると、左心房は左心室へ血液を送るのに力が必要になってしまいます。左心房に負担がかかると、左心房は大きくなってしまいます。こうなると心房細動が生じて、左心房内に血液がよどんで血栓が出来やすくなります。
人工弁には生体弁と機械弁の2種類があります。生体弁は、ウシの心膜やブタの心臓弁を加工したものです。一方、機械弁は炭素線維やチタンからできています。
生体弁で心房細動のない患者さんでは、血栓を作る可能性はそれほど高くありませんので、手術後から3ヶ月ほど抗凝固薬を内服しますが、その後は内服の必要はないとされています。ただし、心房細動のある場合には、生体弁でも長期的に抗凝固薬を飲まなくてはなりません。
機械弁の最大のメリットはすぐれた耐久性です。しかし、機械弁の場合には血栓が出来やすくなります。患者さんは、生涯に渡って抗凝固薬を内服しなければなりません。
弁膜症性心房細動の患者さんでは、ワーファリンを用いた方がいいとされます。ワーファリンの効果は、プロトロンビン時間(PT)という血液検査値をもとに評価します。ワーファリン内服中の患者さんは、定期的に血液検査を行い、ワーファリンの効果が十分か、あるいは効きすぎていないかを確認する必要があります。PT-INRという評価方法で、2.0~3.0(70歳以上では1.6~2.6)になるようにするのが推奨されています。
非弁膜症性心房細動
非弁膜症性心房細動の場合には、すべての患者さんにワーファリンを使用するわけではありません。
ワーファリンはとても怖い薬です。効きすぎると出血傾向が現れます。怪我をしたときに血が止まらなくなり、消化管出血や鼻出血などが増えます。最も怖いのは、脳出血の可能性が高まり、しかも脳出血した場合には出血が大きくなり、また手術の際に血が止まらなくなります。
非弁膜症性心房細動の患者さんに対してワーファリンを使用するかどうかは、CHADS2スコアを用いて決定します。
CHADS2スコア

心不全(Congestive heart failure)、高血圧(Hypertension)、年齢(Age)≧75、糖尿病(Diabetes mellitus)、以前の脳梗塞/一過性脳虚血発作(Stroke/TIA)といった因子は脳梗塞の発生率を上昇させる因子であり、こうした因子を複数有する人では脳梗塞が起こりやすいことが知られています。
CHADS2スコアは簡便であることから、脳梗塞のリスク評価として専門外の医師でも非弁膜症性心房細動における抗凝固療法の適応を考慮する上で非常に有用です。
CHADS2 スコアが2 点以上では、抗凝固療法が推奨されています。一方、1 点以下の低リスク症例に対する抗凝固療法については考慮可ということになっています。
前述のように、CHADS2 スコアが2 点以上では、脳梗塞を起こす可能性が比較的高いとされ、抗凝固療法が推奨されています。しかし、1 点の低リスク症例に対して抗凝固療法を行うべきかどうかについて、不明確です。実際、CHADS2スコアで1点以下の患者さんは約半数に上るようです。
そこで欧州心臓学会では、2010 年8 月に新ガイドラインを発表し、CHADS2-VAScスコアを導入しました。
CHA2DS2-VAScスコア
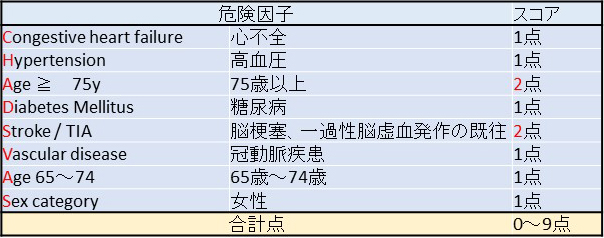
従来のCHADS2 スコアのリスク因子の1つである年齢(75 歳以上)のスコアを1 点から2 点に増やし、新たに3つのリスク因子(血管疾患(心筋梗塞の既往・末梢動脈疾患・大動脈プラーク)、年齢65~74 歳、女性が各1 点)を加え、0~9 点で評価するというものです。
CHADS2 スコアで1点以下の患者さんではワーファリン使用開始の判断に困りますが、そのような患者さんの一部がCHA2DS2-VASc スコアの2 点 以上に相当し、ワルファリン使用が推奨されることになります。CHA2DS2-VASc スコア1 点以下の患者さんは全体の1/4以下になります。
脳梗塞・TIA・血栓塞栓症の既往・75歳以上のうちひとつでも当てはまる場合
➡ ワーファリンが推奨されます。
その他の2つ以上の項目が該当する場合
➡ ワーファリンが推奨
1つの項目が該当する場合
➡ ワーファリンかアスピリン
リスクファクターが1つも存在しない場合
➡ アスピリンもしくは無治療
CHADSスコア2点以上では抗凝固療法を開始し、1点ではCHADS2-VAScを用いて再評価したほうがいいかもしれません。
直接経口抗凝固薬(DOAC)
近年、直接経口抗凝固薬(DOAC)と呼ばれる薬の開発が進み、いくつかの薬が認可されています。DOACは、2015年までは新規経口抗凝固薬(Novel Oral anticoagrant; NOAC)と呼ばれていましたが、もはや新規でもなくなったので呼び名が変わりました。DOACは、非弁膜症性心房細動による心原性脳塞栓症のみに適応があります。
現在、ダビガドラン、リバーロキサバン、アピキサバン、エドキサバンの4種類が本邦で使用可能です。
DOACの利点として、
① 出血性合併症の危険性が低い
② 用量が決まっていて採血による調節の必要がない
③ 食事や併用薬の影響が少ない
④ 半減期が短く、効果の発現や消失までの時間が短い(急性出血や手術時などに有利)
などがあります。
一方、DOACの欠点として、
① ワルファリンと比較して薬価がかなり高い
② 採血などの客観的な効果の確認方法がない
③ ダビガトラン以外では、(出血時などに)効果を打ち消す薬がない
④ 効果が長持ちせず、飲み忘れがあると脳梗塞が起きやすい
などがあります。
日本循環器学会から出ている「不整脈薬物治療ガイドライン(2020改訂版)」によると、DOACは以下のように推奨されています。
CHADS2スコア ≧1点
➡ 推奨 DOAC
➡ 考慮可 ワーファリン
その他のリスク(心筋症、65≦年齢≦74、血管疾患(心筋梗塞、大動脈プラーク、末梢動脈疾患)、腎機能障害、低体重など
➡ 考慮可 DOAC、ワーファリン(年齢によらずINR 1.6~2.6)
僧房弁狭窄症、人工弁(弁膜症性心房細動)
➡ 推奨 ワーファリン(INR 2.0~3.0)



